型糖尿病(T1D)是一種自身免疫性疾病,其特征是胰腺中分泌胰島素的β細(xì)胞遭到破壞。盡管胰島素療法和β細(xì)胞替代治療取得了進(jìn)展,但針對(duì)疾病根本原因(即機(jī)體對(duì)β細(xì)胞免疫耐受的喪失)的根治性療法仍未實(shí)現(xiàn)。當(dāng)前免疫重塑策略聚焦于胰腺自身抗原特異性干預(yù),通過過繼轉(zhuǎn)移體外擴(kuò)增的調(diào)節(jié)性細(xì)胞——包括間充質(zhì)干細(xì)胞(MSCs)、調(diào)節(jié)性T細(xì)胞(Tregs)及樹突狀細(xì)胞(DCs),統(tǒng)稱調(diào)節(jié)性細(xì)胞療法。
免疫調(diào)節(jié)新范式:三系細(xì)胞療法攻克1型糖尿病的進(jìn)展與突破
近期,歐洲免疫學(xué)雜志主頁發(fā)表了一篇“1型糖尿病調(diào)控細(xì)胞療法的進(jìn)展:新興戰(zhàn)略與未來方向”的文獻(xiàn)綜述[1]。

本綜述旨在概述當(dāng)前正在開發(fā)的基于調(diào)節(jié)性細(xì)胞的1型糖尿病治療方案。多項(xiàng)臨床試驗(yàn)已證實(shí)向T1D患者體內(nèi)輸注調(diào)節(jié)性細(xì)胞的安全性,但僅報(bào)告了輕微的有效性跡象。在病程較短且殘余β細(xì)胞量較高的患者中觀察到最具前景的療效,這表明早期干預(yù)可能帶來臨床獲益。該療法仍面臨重大挑戰(zhàn),包括輸注產(chǎn)品的長期療效和穩(wěn)定性。
未來,將調(diào)節(jié)性細(xì)胞療法與免疫調(diào)節(jié)劑或胰島β細(xì)胞修復(fù)策略相結(jié)合,可能成為實(shí)現(xiàn)T1D功能性治愈的關(guān)鍵。
什么是1型糖尿病,目前治療1型糖尿病主流方式有哪些?
1型糖尿病(T1D)是一種慢性自身免疫性疾病,其特征是主要由自身反應(yīng)性T細(xì)胞驅(qū)動(dòng)選擇性破壞胰島素分泌β細(xì)胞,導(dǎo)致胰島素缺乏和高血糖。
當(dāng)前臨床管理依賴外源性胰島素治療,但需持續(xù)監(jiān)測(cè)血糖水平并逐步增加劑量。臨床試驗(yàn)表明,Teplizumab短期療程可顯著延緩T1D患者高風(fēng)險(xiǎn)非糖尿病親屬的臨床發(fā)病進(jìn)程,并顯著提升新診斷T1D患者的刺激后C肽水平。這些成果促成Teplizumab成為首個(gè)獲批治療T1D的藥物,通過保護(hù)β細(xì)胞功能延緩疾病進(jìn)展,為改變病程提供了新治療選擇。

替代受損胰島素分泌細(xì)胞的策略主要包括胰島移植或胰島素聯(lián)合降糖藥物改善代謝控制。自2000年代初埃德蒙頓方案實(shí)施以來,胰島移植已成功應(yīng)用于血糖控制不穩(wěn)定的患者,其安全性和有效性得到廣泛證實(shí)。但該技術(shù)受限于供體胰腺稀缺、胰島提純效率低及需終身免疫抑制等問題。為突破這些限制,新型胰島移植位點(diǎn)、封裝系統(tǒng)及自體誘導(dǎo)多能干細(xì)胞(iPSC)源胰島移植等研究已取得積極進(jìn)展。
最近有報(bào)道稱,一名長期患有1型糖尿病 (T1D) 的患者在移植自體iPSC衍生胰島后,經(jīng)過1年的隨訪,血糖水平仍維持正常。
為保護(hù)β細(xì)胞功能并改善代謝控制,胰高血糖素樣肽-1受體激動(dòng)劑(如利拉魯肽)作為胰島素輔助治療,可降低胰島素需求量并優(yōu)化血糖控制。
盡管上述療法為T1D治療開辟了新途徑,但均未針對(duì)疾病根源——即自身反應(yīng)性T細(xì)胞介導(dǎo)的β細(xì)胞免疫攻擊。因此,重建胰腺抗原免疫耐受仍是未滿足的醫(yī)療需求。在此背景下,多種基于調(diào)節(jié)性細(xì)胞的療法已在臨床試驗(yàn)中開發(fā)驗(yàn)證。

本綜述將重點(diǎn)闡述基于過繼轉(zhuǎn)移免疫調(diào)節(jié)細(xì)胞(包括干細(xì)胞樣細(xì)胞、T淋巴細(xì)胞及抗原呈遞細(xì)胞)的最新治療進(jìn)展(圖1),這些療法旨在逆轉(zhuǎn)T1D自身免疫反應(yīng)。此類策略有望與β細(xì)胞替代/保護(hù)方案形成互補(bǔ):在T1D早期階段阻斷對(duì)殘余功能β細(xì)胞的免疫攻擊,或在長期患者中保護(hù)新重建的胰島素分泌細(xì)胞。

目前正在臨床試驗(yàn)(上圖)或臨床前開發(fā)(下圖)中研究的策略,基于干細(xì)胞(左圖)、Tregs(中圖)或DCs(右圖)。
1、干細(xì)胞療法通過免疫調(diào)節(jié)治療1型糖尿病:阻斷β細(xì)胞破壞
自體造血干細(xì)胞療法:基于”在重建初始免疫耐受系統(tǒng)前清除自身反應(yīng)性免疫細(xì)胞”的理論基礎(chǔ),結(jié)合造血干細(xì)胞(HSCs)已知的免疫調(diào)節(jié)活性,自體HSC移植已應(yīng)用于T1D患者治療。
該療法在短中期內(nèi)可維持良好代謝控制,顯著提升胰島素非依賴性。但長期隨訪數(shù)據(jù)有限,且存在不同程度的自身免疫復(fù)發(fā)率。盡管療效確切,由于存在致命并發(fā)癥風(fēng)險(xiǎn)及需精準(zhǔn)篩選獲益患者亞群,其風(fēng)險(xiǎn)獲益比仍存爭議。
為降低自體HSC移植后疾病復(fù)發(fā)風(fēng)險(xiǎn),目前正研究改造HSCs使其表達(dá)共抑制分子程序性死亡配體1(PD-L1)的新策略。該創(chuàng)新療法可能通過PD1-PD-L1抑制軸作用于自身反應(yīng)性T細(xì)胞,從而規(guī)避T1D患者自體HSC移植后的復(fù)發(fā)風(fēng)險(xiǎn)。
創(chuàng)新間充質(zhì)干細(xì)胞療法:目前學(xué)界亦在探索替代性干細(xì)胞方案以規(guī)避HSC移植風(fēng)險(xiǎn)。間充質(zhì)干細(xì)胞(MSCs)作為成纖維細(xì)胞樣多能基質(zhì)細(xì)胞,可從多種組織中分離。MSCs通過釋放可溶性因子或細(xì)胞間接觸機(jī)制重塑免疫反應(yīng),抑制效應(yīng)T細(xì)胞功能。
異體HSC移植后直接注射MSCs治療移植物抗宿主病的實(shí)踐已顯示免疫調(diào)節(jié)效應(yīng),進(jìn)而推動(dòng)其在實(shí)體器官移植及類風(fēng)濕關(guān)節(jié)炎、克羅恩病、多發(fā)性硬化癥和系統(tǒng)性紅斑狼瘡等自身免疫/炎癥疾病中的應(yīng)用。多項(xiàng)研究證實(shí)其雖效果短暫但具臨床獲益。
對(duì)T1D而言,MSCs兼具促進(jìn)β細(xì)胞再生與免疫調(diào)節(jié)雙重潛力。臍帶血(UCB)或骨髓源MSCs的直接體內(nèi)給藥已在T1D不同病程(新發(fā)/長期)患者中測(cè)試(表1)。
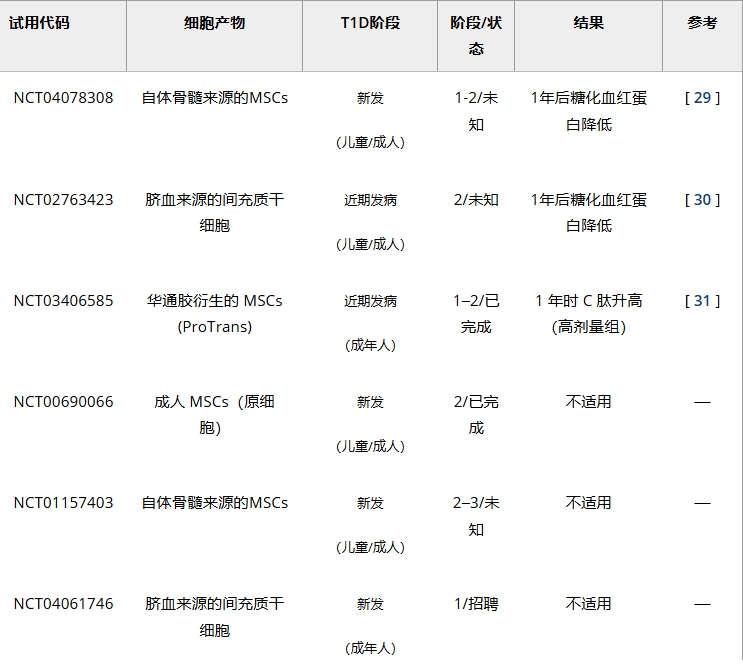
目前有限數(shù)據(jù)表明其安全性良好,干細(xì)胞治療1型糖尿病且在保護(hù)β細(xì)胞功能方面具治療潛力,但仍需更廣泛長期試驗(yàn)驗(yàn)證持續(xù)獲益。
干細(xì)胞教育療法應(yīng)用:免疫調(diào)節(jié)MSCs的應(yīng)用正向體外方向拓展:通過單核細(xì)胞與貼壁UCB-MSCs共培養(yǎng)實(shí)現(xiàn)免疫重編程。
這種”干細(xì)胞教育療法”(SCE)已在涵蓋兒童/成人、不同病程的T1D患者臨床試驗(yàn)中驗(yàn)證(表1)。結(jié)果證實(shí)SCE安全性及其重塑外周T細(xì)胞區(qū)室的能力:增加調(diào)節(jié)性T細(xì)胞(Tregs)與CD4+初始T細(xì)胞,恢復(fù)細(xì)胞因子平衡。短期代謝控制僅輕微改善,而β細(xì)胞保護(hù)效應(yīng)僅見于治療時(shí)具殘余β細(xì)胞功能的患者。
外泌體療法拓展:基于MSCs旁分泌活性的胞外囊泡(如外泌體)療法,經(jīng)炎癥性疾病驗(yàn)證具臨床潛力,現(xiàn)正于T1D臨床試驗(yàn)(NCT02138331)評(píng)估其應(yīng)用價(jià)值。該策略規(guī)避了活細(xì)胞移植風(fēng)險(xiǎn),為免疫調(diào)節(jié)提供新路徑。
大量正在進(jìn)行的臨床試驗(yàn)的結(jié)果可能會(huì)揭示基于干細(xì)胞的療法治療1型糖尿病的潛力。
2、調(diào)節(jié)性T細(xì)胞療法:重建1型糖尿病的免疫耐受性
調(diào)節(jié)性T細(xì)胞(Tregs)——包括表達(dá)叉頭框P3的Tregs(FOXP3+Tregs)和分泌IL-10的1型調(diào)節(jié)性T細(xì)胞(Tr1)——被公認(rèn)為維持健康與疾病狀態(tài)下外周免疫耐受的關(guān)鍵細(xì)胞。在T1D患者中,研究顯示存在Tregs穩(wěn)定性、功能及數(shù)量的缺陷,或效應(yīng)細(xì)胞對(duì)抑制作用的抵抗。
體外擴(kuò)增的自體多克隆CD4+CD127loCD25+Tregs是首個(gè)應(yīng)用于T1D兒童及成人患者的Treg療法(臨床試驗(yàn)號(hào):ISRCTN0612846, NCT01210664, Treg-TID研究)(表2)。
結(jié)果證實(shí)該方法安全性良好,但療效僅見于兒童隊(duì)列:隨訪1年時(shí)β細(xì)胞功能得以維持,且病程較短患兒代謝改善更顯著。然而2年后所有患者疾病進(jìn)展均需依賴胰島素治療。

近期開展的Trex研究(NCT02691247,表2)將體外擴(kuò)增Treg療法應(yīng)用于更大規(guī)模的新發(fā)T1D兒童隊(duì)列。結(jié)果顯示:無論輸注劑量高低,Treg均未能保護(hù)殘余β細(xì)胞功能。值得注意的是,體外增殖率較低的細(xì)胞產(chǎn)品與C肽下降減緩相關(guān),提示Treg療效可能與其增殖特性呈負(fù)相關(guān)。
臍帶血Tregs與IL-2聯(lián)用挑戰(zhàn)
臍帶血源Tregs試驗(yàn)(NCT02932826/NCT03011021)顯示病程較短者療效更優(yōu)。輸注Tregs因體內(nèi)IL-2不足快速衰減,IL-2聯(lián)合療法(TILT試驗(yàn),NCT02772679)雖維持Tregs數(shù)量卻未能保護(hù)胰島功能。新型嵌合IL-2構(gòu)建體(TiilT項(xiàng)目)通過靶向炎癥位點(diǎn)增強(qiáng)Tregs存活與控制炎癥能力。
B細(xì)胞清除聯(lián)合療法突破
Tregs聯(lián)合利妥昔單抗清除B細(xì)胞(ISRCTN37116985)實(shí)現(xiàn)部分患者2年胰島素非依賴,亞組治療12年后仍處臨床緩解期。針對(duì)癥狀前期T1D的聯(lián)合療法試驗(yàn)(NCT06688331)有望揭示病程對(duì)療效影響。?
工程化Tregs成為調(diào)節(jié)性T細(xì)胞療法治療1型糖尿病的新方向
總體而言,目前的結(jié)果表明輸注的Treg缺乏長期療效,因此對(duì)該領(lǐng)域提出了新的挑戰(zhàn)。為了改進(jìn)Treg療法,正在研究增強(qiáng)Treg功能的策略,包括利用轉(zhuǎn)基因T細(xì)胞受體 (TCR) 進(jìn)行工程改造。事實(shí)上,已經(jīng)從胰島浸潤的致病T細(xì)胞中分離出3種TCR。
- 01、ARTiDe聯(lián)盟結(jié)合機(jī)器學(xué)習(xí)方法、體外和體內(nèi)臨床前研究以及臨床級(jí)流程,旨在開發(fā)新型TCR工程化Treg,以在針對(duì)1型糖尿病 (T1D) 患者的I期臨床試驗(yàn)中進(jìn)行測(cè)試。與此同時(shí),
- 02、Abata Therapeutics開發(fā)了HLA-DR4限制的胰島素原靶向TCR工程化 Treg,可在體外直接或通過感染耐受機(jī)制微調(diào)自身免疫反應(yīng)。
- 03、ABA-201產(chǎn)品預(yù)計(jì)預(yù)計(jì)2025年啟動(dòng)I期臨床試驗(yàn)
關(guān)鍵瓶頸:靶點(diǎn)選擇(如HPi2-CAR因Tregs自身表達(dá)靶抗原導(dǎo)致失敗)
總體而言,在1型糖尿病 (T1D) 研究中,Treg療法旨在通過改善其特異性并提高體內(nèi)強(qiáng)度和存活率來增強(qiáng)注入的Treg產(chǎn)品。
3、耐受性樹突狀細(xì)胞:逆轉(zhuǎn)1型糖尿病的自身免疫
樹突細(xì)胞(DCs)是主導(dǎo)適應(yīng)性免疫應(yīng)答的專業(yè)抗原呈遞細(xì)胞(APCs)。耐受性DC(TolDCs)作為特定DC亞群,其特征為低表達(dá)共刺激分子、分泌抗炎細(xì)胞因子,并能調(diào)節(jié)效應(yīng)T細(xì)胞應(yīng)答、誘導(dǎo)T細(xì)胞失能或促進(jìn)Tregs分化。TolDCs可從循環(huán)單核細(xì)胞體外誘導(dǎo)生成,使其成為”反向疫苗接種”策略的理想工具。
近20年前,T1D成為首個(gè)接受過繼性TolDC療法的自身免疫病。該研究中(NCT00445913),通過靶向CD40-CD80-CD86的反義寡核苷酸維持DC未成熟狀態(tài),輸注至完全確診的T1D患者(表3)。

治療耐受性良好,但未觀察到血糖控制改善。鑒于該方案的安全性,后續(xù)在近期發(fā)病及新發(fā)T1D患者中啟動(dòng)兩項(xiàng)試驗(yàn)(NCT01947569, NCT02354911),結(jié)果尚未公開(表3)。
新型耐受性樹突狀細(xì)胞制備技術(shù)與初步驗(yàn)證
耐受性樹突細(xì)胞(TolDCs)還可通過以下流程制備:在單核細(xì)胞向DC分化階段,使用維生素D3(VitD3)和地塞米松(Dexa)處理,隨后負(fù)載自身抗原(即VitD3/Dexa TolDC)。
該方案曾用于治療類風(fēng)濕關(guān)節(jié)炎(AutoDECRA試驗(yàn),NCT01352858),并成功抑制類風(fēng)濕關(guān)節(jié)炎進(jìn)展。
應(yīng)用于T1D時(shí),負(fù)載HLA-DR4限制性前胰島素肽(C19-A3)的該方案雖安全性良好,但因患者β細(xì)胞功能嚴(yán)重衰竭未改善血糖,但顯著降低抗原特異性T細(xì)胞應(yīng)答并誘導(dǎo)長效IL-10分泌細(xì)胞。
創(chuàng)新聯(lián)合療法與靶向突破
兩項(xiàng)進(jìn)行中試驗(yàn)探索:1)PipepTolDC在新近診斷成人患者中測(cè)試肽負(fù)載TolDCs(NCT04590872);2)MSC-tolDCs療法將VitD3致耐受DC與MSCs共培養(yǎng)后輸注(NCT05207995),結(jié)果尚未公布。
突破性進(jìn)展來自AVT001——新發(fā)T1D患者接受AVT001(負(fù)載HLA-E限制性熱休克蛋白60衍生肽的自體單核細(xì)胞源DC)治療后(NCT03895996)。該肽段此前被證實(shí)可與CD8+調(diào)節(jié)性T細(xì)胞亞群互作——而該亞群在多數(shù)T1D患者中存在缺陷(表3)。
AVT001治療組1年內(nèi)C肽水平較基線值下降幅度更小,盡管整體血糖控制及胰島素需求未改善。這表明特異性靶向Tregs的TolDC治療1型糖尿病的策略目前成效最為顯著。
結(jié)論
盡管已有大量臨床試驗(yàn)報(bào)道,逆轉(zhuǎn)T1D自身免疫反應(yīng)仍面臨挑戰(zhàn)。過繼性轉(zhuǎn)移免疫調(diào)節(jié)細(xì)胞為下一代細(xì)胞療法指明了關(guān)鍵方向:
- 治療時(shí)機(jī)前移:需在疾病早期(理想狀態(tài)為癥狀前期)干預(yù)。為此,除胰島自身抗體外,亟需更優(yōu)生物標(biāo)志物識(shí)別T1D患者高風(fēng)險(xiǎn)一級(jí)親屬;
- Treg療法局限性:依賴FOXP3的調(diào)節(jié)性T細(xì)胞因體內(nèi)適應(yīng)能力不足,僅產(chǎn)生輕微療效;
- 新型耐受策略:體內(nèi)誘導(dǎo)非FOXP3依賴的抗原特異性Tregs(如過繼性TolDC療法或MHC-抗原納米顆粒),可能實(shí)現(xiàn)更持久、自我延續(xù)的免疫耐受。
唯有跨越單一療法局限,構(gòu)建”免疫穩(wěn)態(tài)重置-β細(xì)胞再生”的協(xié)同網(wǎng)絡(luò),方能在攻克T1D的征途上實(shí)現(xiàn)從血糖控制到功能性治愈的歷史性飛躍。
主要參考資料:
[1]https://onlinelibrary.wiley.com/doi/10.1002/eji.202451722
免責(zé)說明:本文僅用于傳播科普知識(shí),分享行業(yè)觀點(diǎn),不構(gòu)成任何臨床診斷建議!杭吉干細(xì)胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。如有版權(quán)等疑問,請(qǐng)隨時(shí)聯(lián)系我。



 掃碼添加官方微信
掃碼添加官方微信